Un passo avanti straordinario nel campo delle terapie per i tumori del sangue. Un'innovazione a 360 gradi pensata per quei pazienti rimasti finora senza cura. Così Novartis definisce tisagenlecleucel, la prima terapia Car-T autorizzata «su tutto il territorio italiano».
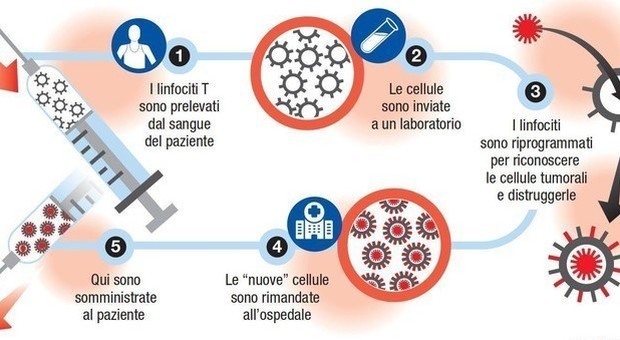
«Si tratta - prosegue la casa farmaceutica elvetica - di un trattamento vivo, una immunoterapia cellulare autologa, prodotta a partire dai linfociti T del paziente, riprogrammati per identificare ed eliminare le cellule esprimenti CD19, in modo altamente personalizzato. Tisagenlecleucel è in grado di restituire al sistema immunitario del paziente, attraverso un processo altamente personalizzato per ogni individuo, la sua naturale capacità di riconoscere ed eliminare le cellule tumorali».
LEGGI ANCHE Tumori, scoperto un nuovo bersaglio blocca-cancro: lo studio della Sapienza e del Bambino Gesù
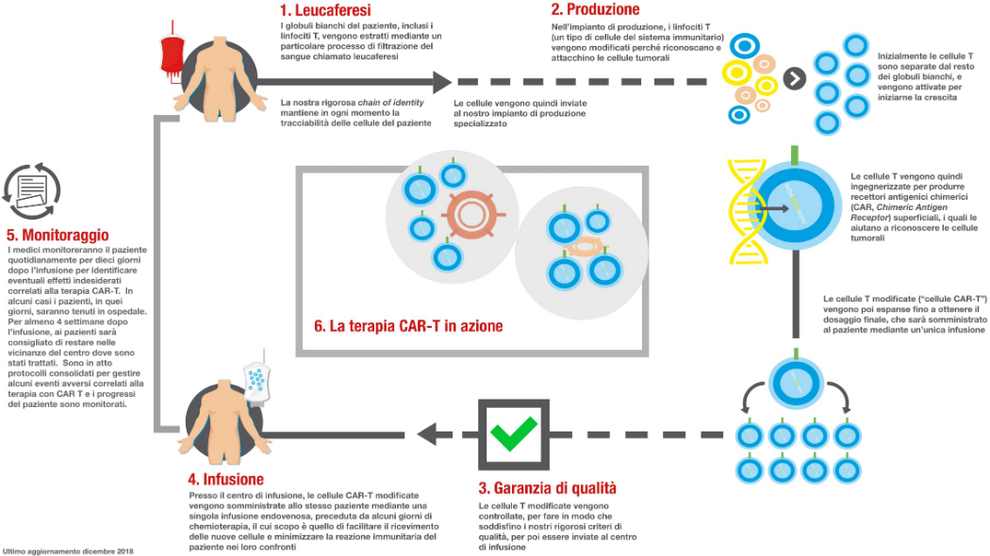
La terapia «intreccia le tre tecnologie più d'avanguardia in campo oncologico: immunoterapia, terapia cellulare e terapia genica. Ed è l'unico Car-T a essere indicato in bambini e ragazzi con Leucemia Linfoblastica Acuta a cellule B e in adulti con Linfoma diffuso a grandi cellule B, che siano diventati resistenti alle altre terapie, o nei quali la malattia sia ricomparsa dopo una risposta ai trattamenti standard. Una nuova occasione per questi pazienti con forme aggressive di tumori ematologici per i quali non vi sarebbero più altre opzioni di cura», sottolinea l'azienda elvetica. La terapia si avvale di tecniche di ingegneria genetica, che sono in grado di inserire un gene nei linfociti T che così esprimeranno il recettore chimerico per l'antigene (Car -Chimeric Antigen Receptor). Questo ricettore è chiamato chimerico perché, come la chimera, la figura mitologica formato da parti del corpo di animali diversi, è costituito da porzioni di molecole diverse.
Alla Fondazione Monza e Brianza per il Bambino e la sua Mamma all'Ospedale San Gerardo d Monza - ricorda la Novartis in una nota - c'è l'unico centro in Italia a sperimentare tisagenlecleucel in ambito pediatrico: fin'ora ha trattato 10 bambini. «Al valore scientifico di questa assoluta novità terapeutica si aggiunge il valore clinico perché la sua efficacia è profonda e duratura, anche in pazienti molto fragili», commenta Andrea Biondi, direttore della Clinica pediatrica dell'Università Milano Bicocca presso la Fondazione Monza e Brianza per il Bambino e la sua Mamma all'Ospedale San Gerardo di Monza.
Biondi afferma che «Tisagenlecleucel rappresenta una reale opportunità per questi pazienti e per le loro famiglie, dato che ha dimostrato un tasso di remissione globale dell'81%, con una risposta dal carattere completo e una sopravvivenza libera da recidiva duratura al follow-up, in oltre il 55% dei casi. È bene sottolineare che siamo solo all'inizio di una nuova pagina della medicina: gestione del profilo di tollerabilità del trattamento, sostenibilità della produzione e delsistema, sono elementi che rendono necessario continuare ad investire in questo settore da tutti gli attori coinvolti nel Sistema».
I dati finora disponibili sulla prima Car- t approvata in Italia «ci mostrano una durata prolungata della risposta e una probabilità di sopravvivenza che si mantiene stabile con il tempo». Lo afferma Fabio Ciceri, presidente Gitmo, Gruppo italiano trapianto di midollo osseo e direttore Uo Ematologia e trapianto di midollo, Irccs ospedale San Raffaele di Milano, in una nota diffusa da Novartis.
La nuova terapia (Tisagenlecleucel) di Novartis «dimostra che si può guarire uno stadio di malattia fino a ieri considerato non curabile - aggiunge Ciceri - Sono circa 700 pazienti che ogni anno esauriscono le opzioni terapeutiche standard e che, grazie a terapie di questo tipo, avranno un nuovo orizzonte di vita».
«Siamo molto contenti per l’approvazione di una terapia che attendevamo da tempo, perché si tratta di una cura salvavita in pazienti con linfoma diffuso a grandi cellule B e leucemia linfoblastica acuta a cellule B, che hanno una malattia refrattaria o ricaduta e che quindi non hanno altre opzioni terapeutiche».
Car-T, approvata dall’Agenzia Italiana del Farmaco nuova cura per le leucemie
Mercoledì 7 Agosto 2019
Così il Prof. Paolo Corradini, Presidente della Società Italiana di Ematologia (SIE) e Direttore della Divisione di Ematologia della Fondazione IRCCS Istituto Nazionale dei Tumori di Milano commenta a nome di tutti gli ematologi italiani il via libera alla rimborsabilità della prima terapia a base di cellule CAR-T.








